
鐵死亡是一種氧化細胞死亡,其關鍵代謝過程至今仍未被完全了解。近日,億納譜團隊聯合上海交通大學團隊、得克薩斯大學西南醫學中心團隊在Developmental Cell (IF=10.7)上在線發表題為“Mitochondrial CCN1 drives ferroptosis via fatty acid β-oxidation”的研究論文,該研究發現線粒體CCN1通過脂肪酸β-氧化驅動鐵死亡。研究組發現CCN1是一種可誘導的線粒體蛋白,它能增強FAO依賴性鐵死亡,這為基于鐵死亡的癌癥治療提供了重要的見解。
鐵死亡是一種細胞死亡的非凋亡機制,以鐵積累和廣泛的脂質過氧化為特征。這一過程破壞氧化還原平衡,并受到分子途徑的可變調節。經典誘導劑,如erastin和(1S,3R)-RSL3 (RSL3)靶載體家族7成員11 (SLC7A11)和谷胱甘肽過氧化物酶4 (GPX4)抑制抗氧化防御,增強鐵死亡在克服耐藥性癌癥和增強免疫治療和放射治療效果中的效用。鐵死亡途徑的異質性強調了識別調節劑以促進治療策略的重要性。
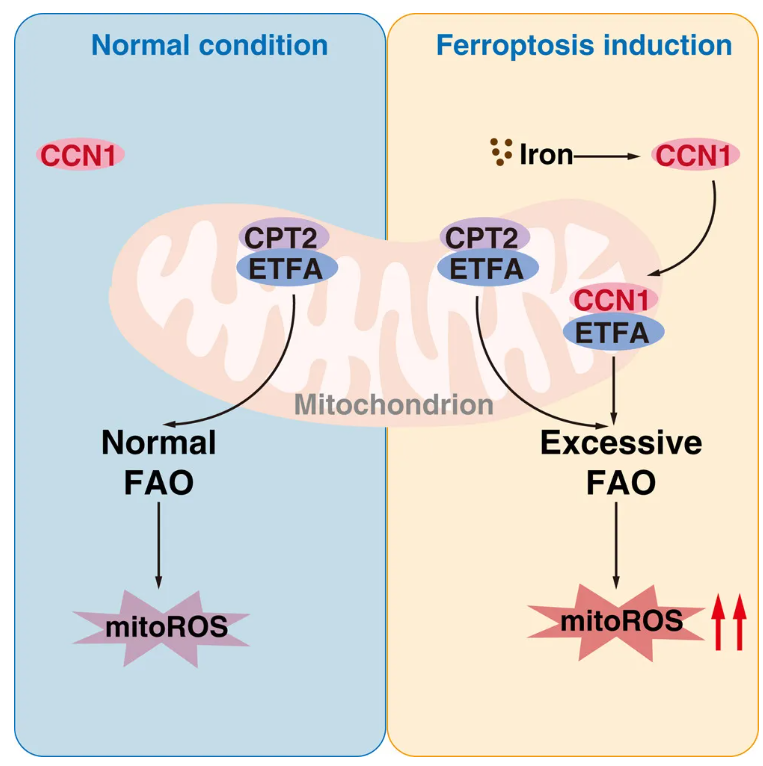
線粒體功能障礙導致氧化應激和鐵死亡,鐵代謝、三羧酸循環和電子傳遞鏈(ETC)活動增加了鐵死亡的易感性。相反,增強線粒體抗氧化防御抑制鐵死亡。線粒體脂肪酸(FA)β-氧化(FAO)在鐵死亡中起著雙重作用。盡管FAO產生的活性氧(ROS)可促進脂質過氧化,FAO還可通過降解脂質過氧化的關鍵底物多不飽和脂肪酸(PUFAs)來防止鐵死亡。非正常線粒體分子,通常為線粒體外分子,可在鐵死亡期間重新定位至線粒體并發揮意想不到的功能,盡管其具體作用和調節機制尚不清楚。
細胞通訊網絡因子1 (CCN1)是一種基質細胞蛋白,通過與整合素和硫酸乙酰肝素蛋白聚糖的相互作用來調節細胞粘附、增殖和凋亡。CCN1還調節氧化應激和脂質代謝,其表達在缺氧條件下增加,從而增加ROS的產生并改變線粒體形態。這些功能強調了CCN1對代謝性疾病的治療潛力。
在此,研究人員采用了一種綜合的多組學篩選方法,確定細胞通訊網絡因子1 (CCN1)是鐵死亡的代謝催化劑。在鐵死亡誘導時,CCN1重新定位于線粒體復合物,促進電子轉移黃素蛋白亞單位α(ETFA)依賴性脂肪酸β氧化。與傳統的肉堿O-棕櫚酰轉移酶2 (CPT2)-ETFA途徑相比,CCN1-ETFA途徑為線粒體活性氧產生提供了額外的底物,從而通過脂質過氧化刺激鐵死亡。高脂飲食可增強肺癌小鼠模型中鐵死亡的抗癌功效,這依賴于CCN1。此外,來源于高甘油三酯血癥或高CCN1表達患者的原發性肺癌細胞在體外和體內表現出對鐵死亡的易感性增加。這些發現不僅確定了線粒體CCN1的代謝作用,而且建立了一種增強基于鐵死亡的抗癌療法的策略。
原文鏈接:https://doi.org/10.1016/j.devcel.2025.04.004
- 上一篇:國際納米科學與化學領域著名學者…
- 下一篇:會議回顧 | “創之聲”第十屆中…

